Kulcskülönbség: Az atomtömeg egyszerűen egy adott izotóp tömege, vagy az atom protonjainak, neutronjainak és elektronainak együttes tömege. Az atomszám az elem magjában található protonok száma.
Nézzünk szembe azzal, hogy a kémia zavaros, az elemek különböző száma, atomszámok, kötések, tömeg, súly, atomok stb. Mindezek a szavak elhomályosodnak egy bizonyos idő után, amit egy személy már nem tud megkülönböztetni a másiktól. Nos, az atomtömeg és az atomszám két olyan szó, amelyek gyakran összetéveszthetők és felcserélhetők.
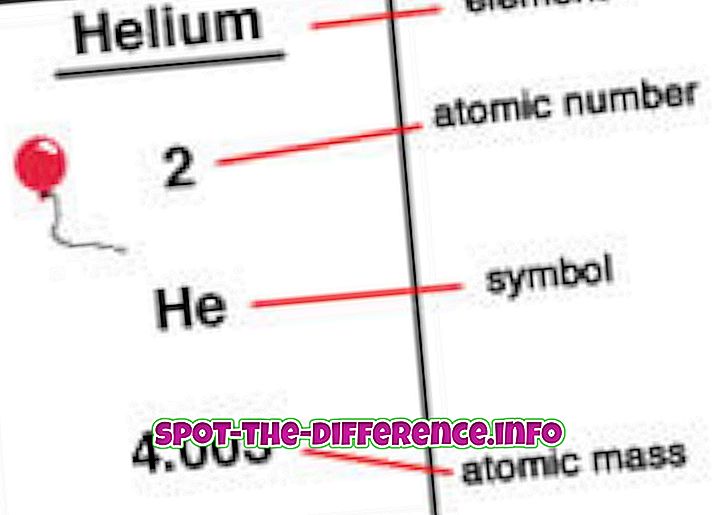
Az atomtömeg egy atom tömege, amikor pihenés van. Ez azért van, mert amikor egy atom nagyon nagy sebességgel mozog, hajlamos a tömeg növekedésére. Bár az atomtömeg a definíció szerint minden proton, neutron és elektron tömege, az elektronok túl kicsi ahhoz, hogy az atomtömegben jelentős különbséget tegyenek. A periódusos rendszer legtöbb elemének izotópja van, és a neutronszám különbségének köszönhetően az egyes izotópok tömege is változik.
Az atommagot atomtömegegységekben vagy amu-ban fejezzük ki. Egy atomtömegegység a Carbon-12 tömegének 1/12-ével egyenlő. Ha egy atom tömegét a Carbon-12 tömegének 12/12 -ével osztjuk meg, akkor az elem relatív tömegét kapjuk. Azonban egy tárgy relatív tömege valójában egy elem atomtömege, mivel azt az összes izotóp figyelembe vételével számítják ki. Ez azonban nem tekinthető elemelem tömegének.

Az atomszám az elem magjában található protonok száma. Ha egy atom semleges, azt jelenti, hogy azonos számú protonja és elektronja van. Az atomszámot egy Z jelöli. Mivel minden elemnek különböző számú protonja van, ez a szám is egy elem ábrázolására szolgál. Az izotópok általában azonos atomszámmal rendelkeznek, de atomi tömegüket, például Carbon-12, Carbon-13-ot használják.
Az elemeket egy periódusos tábla atomszámának sorrendjében helyezzük el. Az atomszám az elem bal felső sarkában feliratként szerepel. Az atomszámok segíthetnek az elemre vonatkozó információk nyilvánosságra hozatalában, és sokan láthatják az atomszámot, és megadják, hogy melyik elemet tartalmaz. Azt is elmondja, hogy a rendszeres táblázatban hol lehet elhelyezni, és hogy folyékony, gáz vagy szilárd. Az atomszám a nukleáris töltés, az oxidációs állapotok, a kötési viselkedés, az ion töltése stb.